Молекулярно-кинетическая теория
Молекулярно-кинетическая теория изучает строение и свойства тел на основе молекулярного строения.
Основные положения МКТ
и их опытное обоснование.
1. Все вещества (тела) состоят из микрочастиц - молекул, атомов или ионов.
2. Микрочастицы находятся в непрерывном движении.
3. Микрочастицы взаимодействуют друг с другом. Между частицами существуют силы притяжения и отталкивания.
Существование микрочастиц - молекул, атомов и ионов подтверждается непосредственным наблюдением в электронных микроскопах, растворимостью твердых тел в жидкостях, механическим дроблением твердых тел, сжимаемостью и проницаемостью веществ.
Непрерывность движения микрочастиц подтверждается диффузией, броуновским движением, способностью газов неограниченно расширятся и занимать весь предоставленный объем.
О взаимодействии микрочастиц позволяют утверждать прочность и упругость веществ, способность жидкостей смачивать некоторые твердые тела, поверхностное натяжение жидкостей и др.
Масса и размеры атомов и молекул.
Молярная масса - физическая величина, равная отношению массы вещества к количеству вещества.
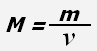
где M - молярная масса, m - масса вещества, ν - количество вещества.
Молярная масса численно равна массе одного моля вещества.
Единица измерения молярной массы - кг/моль.

где Na = 6,022·1023 моль-1 - постоянная Авогадро,
N- число частиц системы, m0 - масса одной молекулы (для веществ атомарного строения - масса атома).
Масса молекулы равна отношению массы всего вещества к количеству молекул в веществе или отношению молярной массы к постоянной Авогадро.
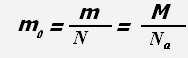
Единица измерения массы молекулы - кг.
Средняя масса молекул 10-23 - 10 -26 кг. Например, масса молекулы воды - 3·10-26 кг.
Размер атома определяется расстоянием от центра ядра до орбит, на которых находятся валентные электроны или расстоянием от центра ядра до внешних заполненных электронных орбит.
Размер молекул - условная величина.
Эффективным диаметром молекулы называют расстояние предельного сближения центров двух молекул. Размеры молекулы порядка 10 -10 м. Например, эффективный диаметр молекулы воды примерно 4·10 -26 м.
Для молекул (атомов) веществ в твердом и жидком состоянии примерный объем одной молекулы (атома) равен отношению всего объема вещества к количеству молекул (атомов).
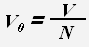
где V0 -объем молекулы или атома.
Взаимодействие молекул и агрегатные состояния.
Межмолекулярное взаимодействие имеет электрическую природу. Молекулы в целом электрически нейтральны, т. к. положительные и отрицательные заряды в них скомпенсированы.
Но электрические поля за пределами молекул существуют и убывают с расстоянием. Посредством этих электрических полей молекулы взаимодействуют друг с другом. Между молекулами действуют одновременно силы притяжения и отталкивания. На малых расстояниях силы отталкивания возрастают быстрее сил притяжения. Зависимость результирующей силы взаимодействия молекул от расстояния между ними представлена на графике:
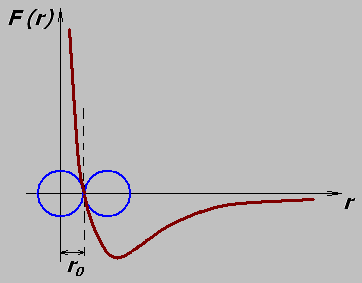
Расстояние между молекулами веществ в различных агрегатных состояниях определят степень взаимодействия молекул и вид теплового движения.
Среднее расстояние между молекулами газа в десятки раз превышает размеры молекул. И поэтому взаимного притяжения между молекулами практически нет. Движение же молекул вещества в газообразном состоянии можно считать движением по инерции: молекулы движутся равномерно и прямолинейно до столкновения в пространстве с другой молекулой, при столкновении они меняют модуль и направление скорости и далее движутся равномерно прямолинейно до следующего столкновения. Так же при столкновении молекулы, состоящие из нескольких атомов могут приобрести и вращательное движение. Следовательно, тепловое движение молекул вещества в газообразном состоянии является поступательным и вращательным.
В жидкостях молекулы располагаются на расстояниях соизмеримых с размерами самих молекул. Благодаря взаимодействию молекула некоторое время (время оседлой жизни молекулы) колеблется в положении равновесия, а затем перескакивает на другое место, имея тем самым возможность перемещаться по всему объему жидкости. Поэтому тепловое движение молекул вещества в жидком состоянии является поступательным и колебательным.
В твердых телах силы притяжения между молекулами сравнительно велики. Молекулы удерживаются в положениях равновесия и совершают колебательные движения. Следовательно, тепловое движение молекул является колебательным.
Модель идеального газа.
Для объяснения свойств вещества в газообразном состоянии в молекулярно-кинетической теории рассматривается модель идеального газа.
Под моделью идеального газа понимают газ, удовлетворяющий следующим условиям:
- молекулы газа обладают пренебрежимо малым объемом по сравнению с объемом сосуда, в котором находится газ;
- между молекулами отсутствуют силы притяжения и молекулы взаимодействуют только при соударении как абсолютно упругие тела;
- тепловое равновесие по всему объему достигается мгновенно.
Реальный газ приближается по своим свойствам к модели идеального газа при значительном разрежении. Но существуют газы, которые и при нормальных условиях близки по своим свойствам к модели идеального газа.
Основное уравнение
молекулярно-кинетической теории газов.
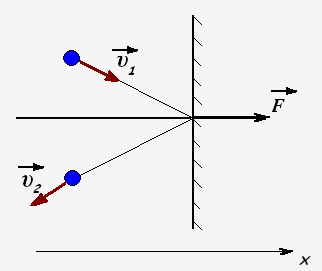
Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен
Fx· t = 2m0 · υx
Пусть за время t о стенку ударяется N частиц, тогда они передадут стенке импульс
N · Fx· t = 2m0 · υx· N
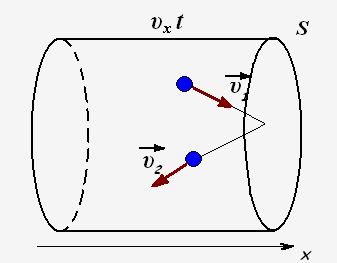
Число ударяющих о стенку молекул можно определить через концентрацию частиц и объем сосуда:
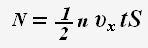
Тогда для проекции импульса силы получаем выражение:
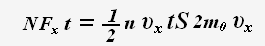
По определению давления:
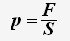
Так как все направления движения частиц равновероятны, то для проекции скорости справедливо равенство:
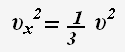
Основное уравнение молекулярно-кинетической теории:
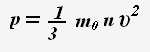
Это уравнение устанавливает связь между микро- и макропараметрами.
Уравнение состояния идеального газа.
Давление газа пропорционально концентрации молекул и его абсолютной температуре
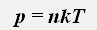
где k=1,38 · 10-23Дж/К -постоянная Больцмана, n -концентрация молекул, Т - абсолютная температура.
Используем равенства для концентрации и числа молекул газа
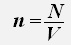
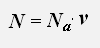
получаем:
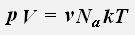
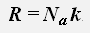
где R = 8,31 Дж/(моль·К) - универсальная газовая постоянная
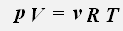
С учетом того, что количество вещества можно определить, зная массу газа и его молярную массу, получаем уравнение состояния идеального газа:
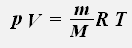
Уравнение состояния идеального газа можно переписать в виде:
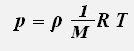
где ρ -плотность газа.
Изопроцессы.
Изопроцесс - процесс, который происходит с данной массой газа при одном неизменном параметре - температуре, давлении, объёме, а так же при отсутствии теплообмена с окружающей средой.
Используя уравнение состояния идеального газа, для заданной массы заданного газа получаем:
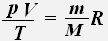
Тогда для двух состояний данной массы газа имеет место равенство:
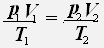
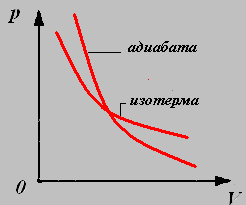
1.Изотермический процесс - процесс протекающий при неизменной температуре.
С учётом того, что температура неизменна, получаем:
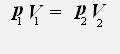 или
или 
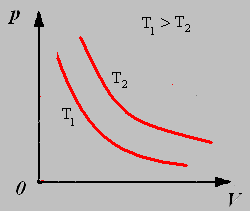
Закон Бойля-Мариотта: Для данной массы газа при постоянной температуре давление газа обратно пропорционально его объему.
График изотермического процесса называют изотермой.
2.Изохорный процесс - процесс протекающий при неизменном объёме.
С учётом того, что объём газа не меняется, получаем:
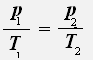 или
или 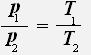
Закон Шарля: Для данной массы газа при постоянном объёме давление газа прямо пропорционально его абсолютной температуре.
График изохорного процесса называют изохорой.
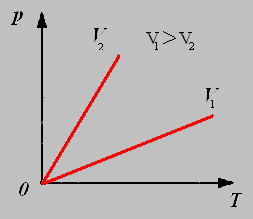
3.Изобарный процесс - процесс протекающий при неизменном давлении.
С учётом того, что давление газа не меняется, получаем:
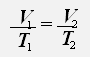 или
или 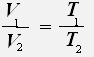
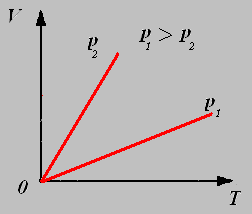
Закон Гей-Люссака: Для данной массы газа при постоянном давлении объём газа прямо пропорционален его абсолютной температуре.
График изобарного процесса называют изобарой.
4. Адиабатный процесс-процесс, происходящий в системе без теплообмена с окружающими телами.
Параметры давления и объёма связаны уравнением Пуассона:
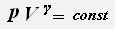 , где γ -показатель адиабаты,
, где γ -показатель адиабаты, 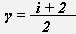 .
.
График адиабатного процесса называют адиабатой.